- Характеристики
- Сферы применения
- Правила работы
- Применение от ржавчины
- Применение для металла
Нередко металл и изделия из него подвергаются характерной «болезни», которая проявляется в виде рыжего налета, разъедающего металл. Речь идет о ржавчине. Ее образование происходит благодаря воздействию на поверхность металлического изделия углекислого газа, кислорода и воды. Безусловно, для того чтобы продлить срок службы изделия из металла необходимо как можно скорее начать борьбу с коррозией. Помочь в этом может обработка ортофосфорной кислотой.
Что такое ортофосфорная кислота
При комнатной температуре это гигроскопичные бесцветные кристаллы ромбообразного вида, которые хорошо растворяются водой. Ортофосфорное соединение считается неорганической кислотой со средней силой. Одна из ее форм – желтоватая или бесцветная сиропообразная жидкость, без запаха, является водным раствором с концентрацией 85%. Другое ее название – белая фосфорная кислота.
Химическое ортофосфорное соединение имеет свойства:
- растворяется в этаноле, воде, растворителях;
- образует 3 ряда солей – фосфатов;
- вызывает ожоги при попадании на кожу;
- при взаимодействии с металлами образует горючий, взрывоопасный водород;
- температура кипения зависит от концентрации – от 103 до 380 градусов;
- жидкая форма склонна к переохлаждению;
- несовместимо с горючими материалами, чистыми металлами, негашеной известью, алкоголем, карбидом кальция, хлоратами;
- при температуре 42,35 градуса плавится, но не разлагается.

Основные способы получения

Впервые в далёком 1694-м английскому химику Роберту Бойлю удалось синтезировать фосфорную кислоту с применением оксида фосфора (V). Простой метод окисления фосфора разбавленной азотной кислотой и до сегодняшних дней широко используется в лабораториях: 3P + 5NO3 +2H2O = 3H3PO4 + 5NO. Нагревание до кипения безводной фосфористой кислоты приводит к разложению её на ядовитый газ фосфин и ортофосфорную кислоту: 4H3PO3 = 3H3PO4 + PH3.
Промышленное значение имеют два варианта получения: термический и экстракционный. Первый заключается в окислении элементарного фосфора при сжигании до оксида (V): P4 + 5O2 = P4O10; и обработке конечного продукта водой: P4O10 + 6H2O = 4H3PO4.
Технически это реализуется различными способами, названными по аббревиатуре запатентовавших компаний:
- IG-процесс объединяет обе реакции в одной колонне, изготовленной из нержавеющей стали с низким процентным содержанием углерода. Фосфор подаётся сверху при помощи сжатого воздуха или пара и сгорает при температурах свыше 2000 °C. Продукт реакции, оксид фосфора (V), поглощает ортофосфорная кислота, равномерно стекающая по стенкам колонны. Она выполняет одновременно несколько важных функций: растворение P2O5, отведение тепла из зоны горения, защита стенок от пламени. Готовая кислота собирается внизу, охлаждается в теплообменнике и снова поступает в колонну. Продукт IG-процесса практически не имеет в составе низших фосфорных соединений, но требует удаления примесного мышьяка, который всегда загрязняет любой фосфор. Эту проблему решает сероводород: он выделяется при введении в раствор сульфида натрия и осаждает сульфид мышьяка, а затем следует фильтрация.
- TVA-процесс предусматривает отделение процесса горения фосфора от поглощения его оксида. В стальной камере сгорания с внешним охлаждением фосфор соединяется с воздухом, затем продукты реакции подпадают в камеру поглощения, где и становятся ортофосфорной кислотой.
- Хёхст-процесс сгорание и поглощение тоже осуществляет раздельно, но утилизирует теплоту реакции горения для генерирования рабочего пара.
При экстракционном способе производства в России природные фосфаты (апатитовые концентраты из Хибин или фосфориты Каратау) обрабатывают водными растворами неорганических кислот. Это позволяет обеспечивать растущие потребности страны в минеральных удобрениях. Образующийся сульфат кальция присоединяет различное количество молекул воды в зависимости от условий, и по этим признакам экстракционные процессы делят на несколько видов:

- Дигидратные (CaSO4·2H2O). Сырьё измельчают и при температуре от 70 до 80 °C подают в реактор отдельно от серной кислоты. Концентрация готового продукта достигается порядка 30%, а сульфат кальция получается в виде дигидрата. Преимущества: относительно низкая температура, позволяющая избежать коррозии; разнообразие используемых фосфатов; переработка больших количеств. Недостатки: исходное сырьё требует предварительной подготовки (размол), а полученный продукт нуждается в дополнительной концентрации.
- Гемигидратные (CaSO4·0,5H2O). Проводятся при более высоких температурах (от 80 до 100 °C), что позволяет получить устойчивую форму кристаллогидрата — гемигидрат сульфата кальция. Ортофосфорная кислота имеет концентрацию от 40 до 48% и не нуждается в дополнительной обработке.
- Комбинированные гемигидратно-дигидратные процессы — заслуга японских учёных. Сырьё обрабатывается при высоких температурах, а образующийся гемигидрат перекристаллизовывается в дигидрат. Получается практически чистый гипс, побочный продукт реакции. Он с успехом восполняет потребности государственной экономики, не имеющей собственных залежей.
Осаждение безводной соли (ангидритный метод) теоретически осуществимо, но в промышленности не используется, так как вызывает серьёзные коррозионные проблемы.
Для концентрирования дигидратного продукта применяют вакуумное испарение, иногда в нескольких последовательно установленных аппаратах. Это не только экономит теплоноситель, но и удаляет фторсодержащие примеси, которые используют в производстве гексафотросиликата водорода H2SiF6. Прочие неорганические загрязнения, соединения мышьяка и кадмия, удаляют осаждением и экстракцией, а чистая кислота перегонкой освобождается от растворителя.
Формула
Кислота ортофосфорная – неорганическое соединение, которое описывается формулой H3PO4. Его молярная масса равна 98 г/моль. Микрочастица вещества построена в пространстве так, что соединяет между собой атомы водорода и кислорода. Формула показывает – химическое вещество обладает таким составом:
| Количество атомов | Процент массы | |
| Водород | 3 | 3,1 |
| Фосфор | 1 | 65,3 |
| Кислород | 4 | 31,6 |
Структура
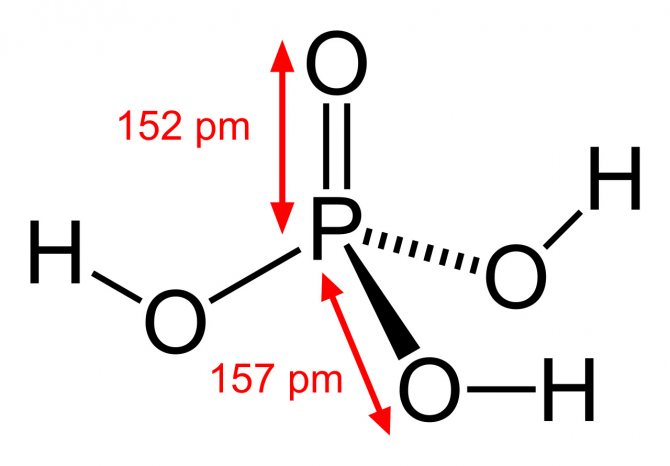
Соединение H3PO4 имеет в общей сложности 32 валентных электрона. Поскольку фосфор является наименее электроотрицательным, он помещается в центре. Атомы водорода присоединяются к внешней стороне атомов кислорода, образуя он-Группы.
В этой структуре каждый атом имеет полную внешнюю оболочку: атомы фосфора и кислорода имеют восемь валентных электронов, а атомы водорода имеют вокруг себя два валентных электрона.
Фосфор может иметь расширенный октет (более восьми валентных электронов), поэтому он получает формальный заряд +1, в то время как кислород (тот, который не присоединен к атому водорода) получает формальный заряд -1. Образуя двойную связь, фосфор и кислород теряют свои заряды.
В структуре все еще есть 32 валентных электрона, и каждый атом имеет формальный заряд, равный нулю. Таким образом, это наиболее вероятная или вероятная структура Льюиса для H3PO4.
Соединение содержит 3 одинарные связи ОН, 3 одинарные связи PO и 1 двойную связь P = O. Каждая одинарная связь является сигма-связью, а двойная связь состоит из сигма-связи и пи-связи.
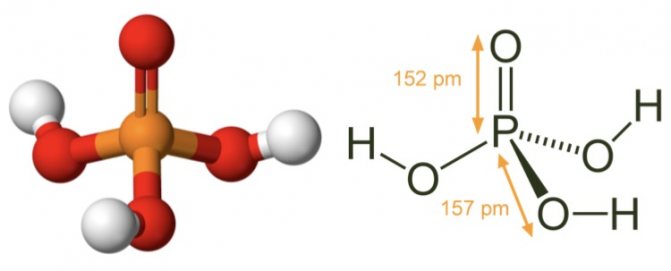
Фосфорная кислота: шарообразная модель и размеры структурной формулы
Молекулярная геометрия PO (OH)3 является тетраэдрической, а кристаллическая структура-моноклинной. А поскольку распределение зарядов на центральных атомах асимметрично, то молекула считается полярной.
Последние в области нанотехнологий, включая методы поглощения рентгеновских лучей вблизи краев и методы рассеяния рентгеновских лучей под большим углом, позволили ученым точно определить структуру фосфорной кислоты. Расстояние связи P=O в структуре близко к 152 пикометрам, и расстояния P=O-O были уточнены до 309 пикометров, с углом связи близким к тетраэдрическому.
Получение фосфорной кислоты
Химическое соединение имеет несколько способов производства. Известный промышленный метод изготовления кислоты ортофосфорной – термический, при котором получается чистый продукт высокого качества. Происходит такой процесс:
- окисление во время сжигания при избытке воздуха фосфора до фосфорного ангидрида, имеющего формулу Р4О10;
- гидратация, абсорбция полученного вещества;
- конденсация фосфорной кислоты;
- улавливание тумана из газовой фракции.
Есть еще две методики производства ортофосфорного соединения:
- Экстракционный способ, отличающийся экономичностью. Его основа – разложение природных минералов-фосфатов соляной кислотой.
- При лабораторных условиях вещество получается взаимодействием белого фосфора, являющегося ядовитым с разбавленной азотной кислоты. Процесс требует строгого соблюдения техники безопасности.
История открытия
Открытие фосфорной кислоты произошло в XVII веке сразу в нескольких независимых лабораториях.
Первые упоминания об открытии фосфора относятся к немецкому ученому Хенингу Брандту. Разорившийся предприниматель, увлекшись алхимическими опытами в поисках «философского камня», подверг тщательном у изучению продукты человеческой жизнедеятельности. Выпарив мочу, и нагрев оставшийся осадок, Брандт получил белое вещество. Дальнейшие опыты с этим веществом заключающиеся в нагревании без доступа кислорода, помогли выделить легкоплавкое вещество с неприятным запахами и парами, светящимися в темноте. Первое название этого вещества имело очень мистический характер. «Холодный огонь», — именно так назвал свое открытие Хенинг Бранд.
В лаборатории англо-ирландского химика Роберта Бойля известного в научных кругах тем, что предпочитал опыт, а не домыслы в 1680 году фосфор был выделен при помощи опытов с индикаторами. Бойль (с подсказки Крафта) проведя ряд экспериментов с жидкостями, кровью, мочой, волосами и костями, поставил производство фосфора на коммерческую основу.
Производство фосфора в XVII веке имело очень успешный коммерческий характер, из-за связи с алхимическими поисками, но в XVIII веке в связи с обнаружением еще одного способа получения (ученым Маргграфам Андреасам Зигизмундом) и его всесторонним раскрытием, перестало иметь коммерческую привлекательность.

Химические свойства
Неорганическое соединение считается трехосновным, имеющим среднюю силу. Характерны такие химические свойства ортофосфорной кислоты:
- реагирует на индикаторы изменением цвета на красный;
- при нагревании преобразуется в пирофосфорную кислоту;
- в водных растворах подвергается трехступенчатой диссоциации;
- при реакции с сильными кислотами образует фосфорилы – комплексные соли;
- образует желтый осадок, взаимодействуя с нитратом серебра;
- термически разлагается до дифосфорной кислоты;
- при контакте с основаниями, аморфными гидроксидами, образует воду и соль.

Экология и безопасность
Экстракционным способом, наименее энергозатратным, получается до 95% общего количества кислоты, а оставшиеся 5% приходятся на термический метод. Главный производитель и потребитель экстракционной H3PO4 — США (порядка 90% мировых объёмов), далее в этом списке — Россия и Марокко. Отвалы загрязнённого сульфата кальция, образующиеся при экстракционном способе, нуждаются в утилизации.
Сегодня они сваливаются на суше, затапливаются в водоёмах и лишь незначительная часть используется в качестве сырья для переработки. Сокращение производства в 80-х годах прошлого века было вызвано отказом от фосфорсодержащих растворителей и минеральных удобрений, загрязняющих грунтовые воды.

Ортофосфорная кислота не имеет специфического влияния, обладает слабой системной токсичностью и по степени воздействия на организм человека относится ко второму классу опасности по ГОСТ 12 .1.005. При увеличении концентрации её пары вызывают изменения слизистых оболочек и крошение зубов, а также кожные воспаления.
Контакт имеет раздражающее действие при концентрации растворов до 10%, а свыше 25% — коррозионное и ожоговое.
Работа с препаратом требует применения индивидуальные средства защиты (респиратора, резиновых перчаток, специальных очков) и соблюдения личных правил гигиены. Проглатывание больших количеств вызывает тошноту, диарею и рвоту. Для ликвидации последствий кожные покровы и глаза промывают тёплой водой или физраствором и внутривенно восполняют потери жидкости.
Применение
Кислота ортофосфорная применяется во многих областях, начиная от промышленности до лечения зубов. Средство используется умельцами как флюс при пайке, для очистки поверхности металла от ржавчины. Жидкость применяется:
- для научных исследований в молекулярной биологии;
- как катализатор процессов органического синтеза;
- для создания антикоррозионных покрытий металлов;
- при производстве огнеупорных пропиток для дерева.
Вещество находит применение:
- в нефтяной промышленности;
- при изготовлении спичек;
- для производства кинопленки;
- с целью защиты от коррозии;
- для осветления сахарозы;
- при изготовлении лекарств;
- в холодильных установках как связующее вещество в составе фреона;
- при механической обработке для полировки, очистки металлов;
- в текстильной отрасли при производстве тканей, имеющих огнезащитную пропитку;
- как компонент при получении химических реактивов;
- в ветеринарии для лечения мочекаменной болезни у норок;
- как составляющая для грунтовки по металлу.
В пищевой промышленности
Широкое распространение получило применение фосфорной кислоты при изготовлении продуктов питания. Она зарегистрирована в реестре пищевых добавок под кодом Е338. При употреблении с допустимыми количествами вещество считается безопасным. Полезными являются такие свойства препарата:
- предотвращение прогоркания;
- регулирование кислотности;
- продление срока годности;
- сохранение вкусовых характеристик;
- усиление действия антиоксидантов.
Кислота ортофосфорная как подкислитель, разрыхлитель, антиоксидант находит применение в хлебопечении, мясной, молочной промышленности. Используется при производстве кондитерских изделий, сахара. Вещество придает продуктам кисловатый, горьковатый вкус. Добавка Е338 входит в состав:
- плавленых сыров;
- сдобы;
- газированных напитков – «Пепси-кола», «Спрайт»;
- колбас;
- булок;
- молока;
- детского питания;
- мармелада;
- тортов.

Исследования показали, что злоупотребление продуктами, содержащими ортофосфорные соединения, особенно газированными напитками, может привести к появлению проблем со здоровьем. Не исключено:
- вымывание из организма кальция, что может спровоцировать образование остеопороза;
- нарушение кислотно-щелочного баланса – добавка способна увеличивать его кислотность;
- появление заболеваний ЖКТ;
- обострение гастрита;
- разрушение эмали зубов;
- развитие кариеса;
- появление рвоты.
В непищевой промышленности
Применение ортофосфорной кислоты можно наблюдать во многих сферах производства. Часто это связано с химическими свойствами продукта. Препарат применяется для изготовления:
- комбинированных, фосфорных минеральных удобрений;
- активированного угля;
- фосфорных солей натрия, аммония, марганца;
- огнезащитных красок;
- стекла, керамики;
- синтетических моющих средств;
- огнеупорных связующих компонентов;
- негорючего фосфатного пенопласта;
- гидрожидкостей для авиационной промышленности.
- Кровотечения после месячных — причины и что делать. Как остановить кровотечение после менструации
- Как варить какао — рецепты с фото. Как приготовить напиток на молоке и воде, горячий шоколад из какао порошка
- Аутоиммунный тиреоидит — лечение народными средствами: рецепты
В медицине
Стоматологи применяют ортофосфорный состав для обработки внутренней поверхности коронки. Это помогает во время протезирования улучшить ее сцепление с зубом. Вещество используется фармацевтами для приготовления лекарств, зубного цемента. В медицине применение ортофосфорного соединения связано со способностью протравливать эмаль зуба. Это необходимо при случае использования для пломбирования адгезивных материалов второго, третьего поколения. Важные моменты – после травления поверхность необходимо:
- промыть;
- просушить.

Обзор эффективных фосфорсодержащих удобрений
Фосфор отвечает за перенос микроэлементов в те органы растения, где в них есть потребность. Без этого элемента невозможно нормальное развитие сельскохозяйственных и огородных культур, особо восприимчивых к дефициту питания. Для получения полноценного урожая необходимо обязательно применять фосфорные минеральные удобрения.
Значение фосфора для растений
Чтобы разобраться, для чего нужны фосфорные удобрения, необходимо выяснить влияние P на представителей растительного мира. Вещество является базовой составляющей питания, поскольку входит в состав ДНК и РНК. Оно отвечает за генеративную функцию растений, поэтому вследствие фосфородефицита растительность может погибнуть полностью.
Несмотря на то, что азот и калий важны для растений наряду с фосфором, отсутствие последнего в грунте может стать причиной гибели планеты из-за тотального истощения земной флоры.
Признаки недостатка элемента
Нехватку фосфора можно определить, не прибегая к лабораторному анализу грунта. При его дефиците на растениях отмечаются следующие проявления:
- приобретение листвой темно-зеленого окраса, сменяющегося на фиолетовый;
- изменение формы листовых пластин и преждевременное опадание цветков;
- появление пятен с более темным оттенком на обратной стороне листвы;
- мельчание культуры;
- выпадение стебля из грунта из-за недоразвитости корневой системы.
Своевременное применение фосфоритов поможет предотвратить подобные проблемы, обеспечить обильное цветение, сохранить урожай, декоративность.
Виды фосфорных удобрений и их применение
Фосфор содержится во многих удобрениях, а вот в каких его больше или меньше – поможет выяснить детальная информация об агрохимикатах.
Суперфосфат
Минеральное соединение бывает 2 видов:
- Простой – гранулированный препарат с 20%-м содержанием основного элемента. В состав включены также сера, магний и кальций. Закладка проводится несколькими способами – при предпосевной обработке грунта, непосредственно в посадочные ямы для укрепления корней и в качестве подкормки на протяжении вегетации.
- Обогащенный – комплекс различных соединений фосфатов кальция, из которых 95% находятся в усвояемой форме. Применение аналогично предыдущему виду.
Аммофос
Фосфорные удобрения бывают и с азотом, а на то, какая в них его доля, влияет ряд факторов. В случае с аммофосом количество N связано с наличием ортофосфорной кислоты в почве. Азотистое соединение выделяется в результате реакции нейтрализации с переизбытком кислоты. Вносить тук можно практически под любую выращиваемую культуру.
Диаммофос
Агрохимикат принято использовать для раскисления почвы. Он показывает превосходный результат в сочетании с органическими средствами (навоз, птичий помет). Закладку проводят в лунки при посадке – около 20 г в каждую.
Метафосфат калия
Другое название фосфорно-калийного удобрения – калиевая соль метафосфорной кислоты. Порошкообразный легкорастворимый в воде агрохимикат, который хорошо усваивается растениями на кислых почвах. В составе содержание PK – 55 и 40% соответственно.
Фосфоритная мука
Препарат включает 30% фосфора в труднодоступной форме, благодаря чему имеет замедленное действие и прекрасно подходит для применения на почвах с кислой реакцией.
Фосфоритная мука – удобрение, которое вносится под перекопку во время осенней обработки грунта.
Костная мука
Средство можно применять при подготовке компоста без включения химии. В результате огород возможно удобрить фосфором, не прибегая к покупке агрохимикатов.
Нитроаммофоска
Универсальное удобрение, содержащее азот, фосфор и калий в пропорции 16:16:16. Благодаря 3 элементам в составе его популярность возрастает с каждым днем: тук подходит для использования на всех агротехнических этапах возделывания растений.
Преципитат
Агрохимикат с долей фосфора в 30%, как в фосфоритовой муке, способен раскислять грунт. Его применение распространяется в двух сферах:
- обогащение плодородного слоя;
- подпитка уже растущих насаждений.
Фосфорно-калийные удобрения: преимущества и правила использования
Применение азотных, фосфорных, калийных минеральных удобрений продиктовано современной агротехникой неспроста. Органика является более безопасной, но для ее получения соединения должны пройти сложный и продолжительный природный цикл. Поэтому аграрии отдают предпочтение химии, обращение с которой требует определенных знаний.
Калийная группа
Химический элемент K в организме растения отвечает за водный баланс, давая возможность культуре на 100% воспользоваться полученной водой. При калиевом голодании растительность плохо переносит засуху и подвержена заболеваниям, нападкам вредителей.
Калий хлористый
Удобрение в виде порошка розового цвета, которое легко растворяется в воде. Из-за значительной доли хлора в составе (около 40%) его применение не рекомендовано для хлорофобных растений (пасленовые, бахчевые и тыквенные культуры). Оптимальное время использования – осень, поскольку за зимний период происходит вымывание Cl. Не стоит применять агрохимикат на слабокислых почвах, поскольку он делает показатель pH еще выше.
Применение от ржавчины
Преобразователь ржавчины на основе ортофосфорной кислоты создает на поверхности защитный слой, оберегающий от коррозии при дальнейшем использовании. Особенность применения соединения – безопасность для металла при нанесении. Существует несколько способов выполнить удаление ржавчины ортофосфорной кислотой, зависящих от размера повреждения:
- травление с погружением в ванну, иную емкость;
- многократное нанесение на металл состава пульверизатором, валиком;
- покрытие поверхности предварительно обработанной механической очисткой.
Ортофосфорное соединение производит преобразование ржавчины в фосфаты железа. Состав можно использовать для промывки и очистки:
- изделий металлопроката;
- скважин;
- поверхностей трубопроводов;
- парогенераторов;
- систем водоснабжения, отопления;
- змеевиков;
- бойлеров;
- водонагревателей;
- теплообменников;
- котлов;
- деталей машин и механизмов.
Применение комплексных удобрений на грядках

Выбирая систему внесения жидких удобрений (органических, минеральных), нужно отталкиваться от сроков и состава почвы.
Жидкие препараты активно применяются в овощеводстве. Американские аграрии давно оценили небольшую концентрацию и связанную с ней безвредность, а также эффективность и удобство применения ЖКУ. Данные международной статистики агропрома указывают, что в большинстве стран жидкие подкормки лидируют на рынке. За рубежом применения началось с 1950, в России — гораздо позже. Основные критерии, благодаря которым российские огородники и садоводы предпочитают жидкие комплексные составы, — хороший подбор компонентов, удобство применения, быстрое усвоение культурами. В результате аграрии получают безвредные и вкусные фрукты и овощи.
Вносить ЖКУ можно разными способами:
- распределить по участку до вспашки и культивации;
- проводить корневые и внекорневые подкормки;
- локально использовать во время посева или в системе фертигации.
Внекорневой обработкой занимаются холодной весной и поздней осенью, когда растениям сложно усваивать фосфор из грунта. К основному раствору можно добавить микробные препараты, регуляторы роста, микроэлементы с учетом состояния растений. Для озимых внекорневое использование ЖКУ предусмотрено в период кущения. Особенно процесс важен там, где осенью не вносили фосфор.
Суспендированные комплексные препараты применяют сплошным методом, равномерно распределяя по поверхности участка до обработки (вскопки, вспашки и пр.).
Выбор между жидкими и сухими удобрениями делается в каждом случае индивидуально. Нужно учесть возможность перевозки и хранения, стоимость входящих в состав компонентов, а также технологическую практику, которая применяется в конкретном хозяйстве.
Серьезных различий в составе твердых и жидких комплексных удобрений нет. Просто жидкости могут быть эффективнее за счет выбранного способа применения. Основное их преимущество — возможность готовить индивидуальные смеси, которые получаются однородными. С твердыми веществами достичь такой однородности не удается, следовательно, и воздействие на грунт будет неравномерным.
Взаимодействие ортофосфорной кислоты
Свойства неорганического вещества определяют его взаимодействие с другими веществами и соединениями. При этом происходят химические реакции. Ортофосфорный состав входит во взаимодействие с:
- солями слабых кислот;
- гидроксидами, вступая в реакцию нейтрализации;
- металлами, находящимися слева от водорода в ряду активности с образованием соли и выделением водорода;
- основными оксидами, участвуя в реакции обмена;
- гидроксидом аммония, создавая гидрофосфат аммония;
- аммиаком с получением кислых солей.

Глобальный рынок
Многие развивающиеся страны начали сосредотачиваться на увеличении добычи фосфатов и производства фосфатов. Правительства некоторых стран уже сотрудничали с различными поставщиками по всему миру для создания заводов по добыче минералов для производства фосфорной кислоты. В 2022 году объем мирового рынка фосфорной кислоты оценивался в 45,85 миллиарда долларов. Ожидается, что к 2027 году он достигнет более 61 миллиарда долларов, а совокупный годовой темп роста составит 3,7%.
Рынок подразделяется на Азиатско-Тихоокеанский регион, Европу, Северную Америку, Латинскую Америку, Ближний Восток и Африку. Ожидается, что в ближайшем будущем Азиатско-Тихоокеанский регион будет доминировать на мировом рынке. Рост рынка фосфорной кислоты в этих регионах будет дополнительно подпитываться развитым сельскохозяйственным сектором Индии и Китая.
Техника безопасности при работе с кислотой
Ортофосфорное соединение относится к классу опасных веществ, требует соблюдения осторожности. Работы с составом должны проводиться в специальном помещении, оснащенном приточно-вытяжной вентиляцией, вдали от источников огня. Недопустимо отсутствие средств индивидуальной защиты:
- респиратора;
- перчаток;
- специальной одежды;
- нескользящих ботинок;
- очков.
Опасно попадание ортофосфорного состава на кожу, в глаза, вредно вдыхание горячих паров. Это может вызвать ожог, головокружение, рвоту, кашель. При экстренных случаях нужно:
- снять одежду, на которую попало вещество;
- промыть место поражения проточной водой;
- вызвать врача;
- наложить свободную повязку;
- разлитую жидкость нейтрализовать щелочью.
Требования к упаковке и правила обращения с веществом

На таре, в которую расфасовывается кислота, обязательно должно быть обозначение “Опасно”, “Едкая жидкость”.
Хранить и транспортировать добавку разрешено в такой упаковке:
- полиэтиленовые канистры;
- стеклянные бутыли;
- контейнеры и автоцистерны из нержавеющей стали, которая прошла специальную обработку;
- пластиковые кубы.
Сами емкости для удобства помещают в полиэтиленовые барабаны или дощатые ящики, внутри которых должен быть мягкий наполнитель во избежание повреждения упаковки.
Попадание вещества на кожу или слизистые, в глаза или в дыхательные пути может вызывать ожоги, тошноту, рвоту, головокружение и нарушение целостности тканей. В таком случае необходимо незамедлительно обратиться за врачебной помощью.
Кислота является опасной в обращении, поэтому работать с ней можно только вдали от открытых источников огня, в хорошо вентилируемом помещении.
Обязательно наличие защитной спецодежды: перчаток, респиратора, очков, ботинок и костюма для работы с опасными веществами.
Правила транспортировки
Существуют специальные ГОСТы, оговаривающие правила перевозки кислоты ортофосфорной, которая относится к опасным грузам. Вещество может доставляться любым видом транспорта. Химически активная жидкость перевозится в плотно закрытых:
- стальных автоцистернах;
- бутылях из полиэтилена, стекла;
- пластиковых кубах;
- бочках;
- канистрах;
- гуммированных железнодорожных цистернах.

Цена
Кислоту ортофосфорную можно приобрести в аптеках, хозяйственных магазинах, заказать через интернет-сайты. Для промышленных целей приобретают оптом со скидками. Средняя стоимость для Москвы в рублях составляет:
| Количество, литр | Средняя цена, р. | |
| Пищевая термическая | 1 | 400 |
| Техническая 85% | 0,8 | 380 |
| 1600 | 13500 | |
| Флюс для пайки | 0,01 | 180 |
| 0,003 | 40 | |
| Пищевая добавка Е388 | 1 | 85 |
О едком и не очень

– Эти идиоты поместили фарфоровый контейнер со «студнем» в специальную камеру, предельно изолированную… То есть это они думали, что камера предельно изолирована, но когда они открыли контейнер манипуляторами, «студень» пошел через металл и пластик, как вода через промокашку, вырвался наружу, и все, с чем он соприкасался, превращалось опять же в «студень». Погибло тридцать пять человек, больше ста изувечено, а все здание лаборатории приведено в полную негодность. Вы там бывали когда-нибудь? Великолепное сооружение! А теперь «студень» стек в подвалы и нижние этажи… Вот вам и прелюдия к контакту.
— А. Стругацкий, Б. Стругацкий «Пикник на обочине»
Привет, %username%!
В том, что я всё ещё что-то пишу — вините вот этого человека. Он навеял идею.
Просто, немного поразмыслив, я решил, что небольшой экскурс по едким веществам получится относительно быстро. Может кому-то будет и интересно. А кому-то — и полезно.
Поехали. Сразу определимся с понятиями.
Едкий — 1. Разъедающий химически. 2. Резкий, вызывающий раздражение, боль. 3. Язвительный, колкий.
Ожегов С.И. Словарь русского языка. — М.: Рус.яз., 1990. — 921 с.
Итак, отбрасываем сразу два последних значения слова. Также отбрасываем «едкие» лакриматоры — которые не столько едкие, сколько вызывают слезотечение, и стерниты — которые вызывают кашель. Да, ниже будут вещества, которые обладают и этими свойствами, но они — что главное! — действительно разъедают материалы, а иногда и плоть.
Мы не будем рассматривать вещества, едкие только для человека и подобных — в виду специфического разрушения мембран клеток. А потому иприты останутся не у дел.
Мы будем рассматривать соединения, которые в комнатных условиях — жидкости. Поэтому жидкий кислород и азот, а также газы типа фтора рассматривать не будем, хотя их можно считать едкими, да.
Как обычно, взгляд будет исключительно субъективным, основанным на собственном опыте. И да — вполне возможно, что кого-то я и не упомню — пиши комментарии, %username%, в течение трёх суток с момента публикации я буду дополнять статью тем, что забылось с самого начала!
И да — у меня нет времени и сил строить «хит-парад», поэтому будет сборная солянка. И со всеми исключениями — она вышла довольно короткой.
Едкие щелочи
А конкретно — гидроксиды щелочных металлов: лития, натрия, калия, рубидия, цезия, франция, гидроксид таллия (I) и гидроксид бария. Но:
- Литий, цезий, рубидий и барий отбрасываем — дорого и редко встретишь
- Если ты, %username%, встретишь гидроксид франция, то едкость тебя будет волновать в последнюю очередь — он жутко радиоактивный
- То же и с таллием — он ядовит до жути.
А потому остались натрий и калий. Но будем откровенны — свойства у всех едких щелочей очень схожие.
Гидроксид натрия известен всем как «каустическая сода» (не путать с пищевой, кальцинированной и другими содами, а также поташем). Гидроксид калия как пищевая добавка Е525 — тоже. По свойствам оба похожи: сильно гигроскопичны, то бишь тянут воду, на воздухе «расплываются». Хорошо растворяются в воде, при этом выделяется большое количество теплоты.
«Расплывание» на воздухе — по сути образование очень концентрированных растворов щелочей. А потому, если положить кусочек едкой щёлочи на бумагу, кожу, некоторые металлы (тот же алюминий) — то по прошествии времени обнаружится, что материал хорошо подъело! То, что показывали в «Бойцовском клубе» — очень похоже на правду: действительно, потные руки — да в щёлочь — будет больно! Лично мне показалось больнее, чем от соляной кислоты (о ней ниже).
Впрочем, если руки очень сухие — скорее всего в именно сухой щёлочи ничего и не почувствуешь.
Едкие щёлочи отлично разваливают жиры на глицерин и соли жирных кислот — так и варят мыло (привет, «Бойцовский клуб!») Чуть дольше, но так же действенно расщепляются белки — то есть в принципе щёлочи плоть растворяют, особенно крепкие растворы — да при нагревании. Недостатком в сравнении с той же хлорной кислотой (о ней тоже ниже) является то, что все щёлочи тянут углекислый газ из атмосферы, а потому сила будет постепенно снижаться. Кроме того, щёлочи реагируют и с компонентами стекла — стекло мутнеет, хотя, чтобы его растворить целиком — тут, конечно, надо постараться.
К едким щелочам иногда относят и тетраалкиламмоний гидроксиды, например
Гидроксид тетраметиламмония
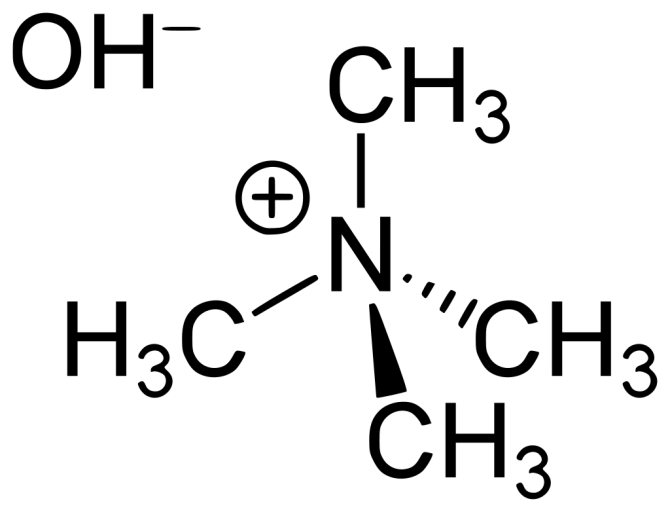
На самом деле в этих веществах объединились свойства катионных поверхностно-активных веществ (ну это как обычное мыло — только катионное: тут активная дифильная частица — с зарядом «+», а в мыле — с зарядом «-«) и относительно высокая основность. Если попадёт на руки — можно намылить в воде и помыть, как мылом, если в водном растворе погреть волосы, кожу или ногти — растворятся. «Едкость» на фоне гидроксидов натрия и калия — так себе.
Серная кислота
H2SO4
Самая популярная, наверное, во всех историях. Не самая едкая, но достаточно неприятная: концентрированная серная кислота (которая 98%) — маслянистая жидкость, которая очень любит воду, а потому у всех её отнимает. Отнимая воду у целлюлозы и сахара, обугливает их. Точно так же она радостно отнимет воду и у тебя, %username%, особенно если налить её на нежную кожу лица или в глаза (ну в глаза на самом деле всё будет попадать с приключениями). Особо добрые люди мешают серную кислоту с маслом, чтобы труднее смывалась и лучше впитывалась в кожу.
Кстати, забирая воду, серная кислота здорово разогревается, что делает картину ещё больше сочной. А потому смывать её водой — очень плохая идея. Лучше — маслом (смывать, а не втирать — а потом уже смыть водой). Ну или большим потоком воды, чтобы сразу и охлаждать.
«Сначала вода, а потом кислота — иначе случится большая беда!» — это именно про серную кислоту, хотя почему-то все считают, что про любую кислоту.
Будучи окислителем, серная кислота окисляет поверхность металлов до оксидов. А поскольку взаимодействие оксидов с кислотами проходит при участии воды как катализатора — а воду серная кислота не отдаёт — то происходит эффект, называемый пассивацией: плотная, нерастворимая и непроницаемая плёнка оксида металла защищает его от дальнейшего растворения.
По этому механизму концентрированную серную кислоту посылают в далёкие дали железо, алюминий. Примечательно, что если кислоту разбавить — появляется вода, и посылать не получается — металлы растворяются.
Кстати, оксид серы SO3 растворяется в серной кислоте и получается олеум — который иногда ошибочно пишут как H2S2O7, но это не совсем верно. У олеума тяга к воде ещё больше.
Собственные ощущения от попадания серной кислоты на руку: немного тепло, потом чуток печёт — смыл под краном, ничего страшного. Фильмам не верьте, но на лицо капать не советую.
Органики часто пользуются хромпиком или «хромовой смесью» — это бихромат калия, растворённый в серной кислоте. По сути это — раствор хромовой кислоты, он хорош для мытья посуды от остатков органики. При попадании на руку тоже жжётся, но по сути — серная кислота плюс токсичный шестивалентный хром. Дырок в руке не дождёшься, разве что на одежде.
Автор этих строк знаком с идиотом, который вместо бихромата калия использовал перманганат калия. При контакте с органикой немножко жахнуло. Присутствующие обделались отделались лёгким испугом.
Кстати, раз уж вспомнили хромпик — немного отвлечёмся от темы кислот и
Хлористый хромил
CrO2Cl2
По сути своей — лютое соединение шестивалентного хрома и соляной кислоты. Тёмно-красная жидкость, которая тянет воду, гидролизуется — и в итоге дымит этой самой соляной кислотой. Едкость — итог этого братского единения: хром — окисляет, соляная кислота — растворяет: воспламеняет некоторые органические растворители (спирт, скипидар), однако в некоторых растворяется (четыреххлористый углерод, дихлорметан, сероуглегод). Подъедает металлы, но не настолько хорошо, как кислоты — опять дело в пассивации. например, сталь при воздействии приобретает красивую тёмно-синию поверхность.
Кожу — понятно — изъязвляет, при чём в этом сильнее хромпика, поскольку лучше проникает в кожу как в неполярную органическую ткань. Но дело даже не в этом, а в шестивалентном хроме, который вообще-то канцероген, а потому глубже проникнет — больше проблем. Ну и конечно надышаться куда опаснее.
Соляная кислота
HCl
Выше 38% в воде не бывает. Одна из самых популярных кислот для растворения — в этом она покруче остальных, потому что технологически может быть очень чистой, а кроме действия, как кислота, ещё и образует комплексные хлориды, которые повышают растворимость. Кстати, именно по этой причине нерастворимый хлорид серебра очень даже растворим в концентрированной соляной кислоте.
Эта при попадании на кожу жжётся чуток сильнее, субъективно — ещё и зудит, к тому же воняет: если в лаборатории с плохой вытяжкой работать много с концентрированной соляной кислотой — твой стоматолог скажет тебе «спасибо»: ты его озолотишь на пломбах. Кстати, помогает жвачка. Но не сильно. Лучше — вытяжка.
Поскольку не маслянистая и с водой сильно не разогревается, то едкость — только к металлам, и то не ко всем. Кстати, сталь в концентрированной соляной кислоте пассивируется и говорит ей «не-а!». Чем и пользуются при транспортировке.
Азотная кислота
HNO3
Тоже очень популярная, её тоже почему-то боятся — а зря. Концентрированная — это которая до 70% — она самая популярная, выше — это «дымящая», чаще всего никому не нужная. Есть ещё безводная — так та ещё и взрывается.
Будучи окислителем, пассивирует многие металлы, которые покрываются нерастворимой плёнкой и говорят: «до свидания» — это хром, железо, алюминий, кобальт, никель и другие.
С кожей моментально реагирует по принципу ксантопротеиновой реакции — будет жёлтое пятно, что означает, что ты, %username%, всё-таки состоишь из белка! Через какое-то время жёлтая кожа слезет, как при ожоге. При этом щиплет меньше соляной, хотя воняет не хуже — и на этот раз токсичнее: летящие окислы азота не очень хороши для организма.
В химии используют так называемую «нитрующую смесь» — самая популярная состоит из серной и азотной кислот. Используется в синтезах, в частности в получении весёлого вещества — пироксилина. По едкости — тот же хромпик плюс красивая жёлтая кожа.
Так же есть «царская водка» — это часть азотной кислоты на три части соляной. Используется для растворения некоторых металлов, в основном — драгоценных. На разном соотношении и добавлении воды основан капельный метод проверки пробы золотых изделий — кстати, специалистов по этому методу очень сложно надурить с подделкой. По едкости для кожи — та же «нитрующая смесь» плюс воняет отменно, запах не спутаешь ни с чем, он тоже довольно токсичный.
Есть ещё «обратная царская водка» — когда соотношение наоборот, но это редкая специфика.
Кстати, о той самой «дымящей», которая красная, злая и окислитель — цитирую рассказ хорошего друга, который мне вот прямо сейчас прислал.
Гнал я эту самую 98% азотку. То ли просто перегонял для очистки, то ли из меланжа, уже не помню. Нагнал литра два, снимаю приемник. Прошу лаборантку дать чистую колбу на 2 литра — перелить. Она мне и дала сухую, чистую, но из под спирта — и с закрытой пробкой. То есть пары были и накопились. Я туда воронку и переливаю. Я ее туда — а она обратно. Хорошо брызнула на руки, на рожу и ниже шеи. Ощущение — как орел в морду вцепился. Плюс руки, шея, под носом ну и т.д. по мелочи. В руках, напоминаю, два литра того же добра. Глаза закрыты, естественно. Понимаю, что бросить колбу нельзя, будет сразу сильно хуже. Аккуратно ставлю колбу на резиновую подставку, перемещаюсь к мойке, разворачиваю гусак себе в морду и включаю полный напор. Секунд за пять управился. До подкожной клетчатки не добралась. А то все было бы намного хуже. Видел у другого мужика, что бывает через 10-15 сек. Труднозаживающие багровые рубцы на половину руки. Потом понял, почему она такая злая. Мало того, что довольно сильная кислота и окислитель, она еще и чудесный растворитель. Неограниченно смешивается с водой, но неограниченно смешивается и с, например, дихлорэтаном. Такая себе бифильная дрянь.
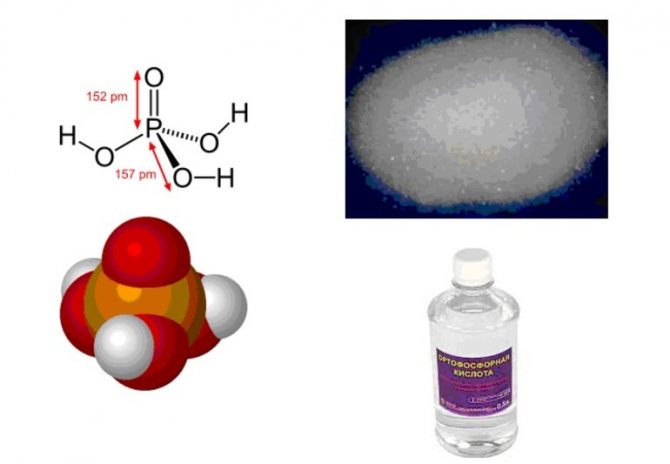
Фосфорная кислота
H3PO4
На самом деле я привёл формулу ортофосфорной кислоты — самой распространённой. А есть ещё метафосфорная, полифосфорные, ультрафосфорные — короче, хватает, но неважно.
Концентрированная ортофосфорная кислота (85%) — это такой сиропчик. Кислота она сама по себе средняя, её часто используют в пищевой промышленности, кстати — когда тебе ставят пломбы, то поверхность зуба предварительно протравливают фосфорной кислотой.
Коррозионность у неё так себе, но есть неприятный нюанс: этот сиропчик хорошо впитывается. Поэтому если капнет на вещи — впитается, а потом будет потихоньку разъедать. И если от азотной и соляной кислоты будет пятно или дырка — то от фосфорной вещь будет разлазиться, особенно это красочно на обуви, когда дырка как бы крошится, пока не получится насквозь.
Ну а вообще едкой её назвать сложно.
Плавиковая кислота
HF
Концентрированная плавиковая кислота — это примерно 38%, хотя и бывают странные исключения.
Слабенькая кислота, которая берёт яростной любовью фторид-ионов образовывать стойкие комплексы со всем, с кем можно. Поэтому на удивление растворяет то, что другие, более сильные подруги — не могут, а потому очень часто используется в разных смесях для растворения. При попадании на руку ощущения будут больше от других компонентов таких смесей, но есть нюанс.
Плавиковая кислота растворяет SiO2. То есть песок. То есть стекло. То есть кварц. Ну и так далее. Нет, если ты плеснёшь на окно этой кислотой — оно не растворится, но мутное пятно останется. Чтобы растворить — нужно долго держать, а ещё лучше — нагреть. При растворении выделяется SiF4, который так полезен для здоровья, что лучше это делать под вытяжкой.
Маленький, но приятный нюанс: кремний содержится у тебя, %username%, в ногтях. Так вот, если плавиковая кислота попадёт под ногти — ты ничего не заметишь. Но ночью спать не сможешь — болеть будет ТАК, что иногда возникает желание оторвать палец. Поверь, друг — я знаю.
И вообще плавиковая кислота токсична, канцерогенна, впитывается через кожу и масса всего — но мы-то сегодня про едкость, правда?
Помнишь, мы договаривались в самом начале, что фтора не будет? Его и не будет. Но будут…
Фториды инертных газов
На самом деле фтор — суровый парень, с ним особо не повыпендриваешься, а потому некоторые инертные газы образуют с ним фториды. Известны такие стабильные фториды: KrF2, XeF2, XeF4, XeF6. Всё это — кристаллы, которые на воздухе с разной скоростью и охотой разлагаются влагой до плавиковой кислоты. Едкость — соответствующая.
Иодоводородная кислота
HI
Самая сильная (по степени диссоциации в воде) бинарная кислота. Сильный восстановитель, чем пользуются химики-органики. На воздухе окисляется и становится бурой, чем и пачкает при контакте. Ощущения при контакте — как от соляной. Всё.
Хлорная кислота
HClO4
Одна из самых сильных (по степени диссоциации в воде) кислот вообще (с ней конкурируют суперкислоты — о них ниже) — функция кислотности Гаммета (численное выражение способности среды быть донором протонов по отношению к произвольному основанию, чем меньше — тем сильнее кислота) составляет -13. Безводная — сильный окислитель, любит взрываться, да и вообще неустойчива. Концентрированная (70%-72%) — окислитель не хуже, часто используют в разложении биологических объектов. Разложение интересно и захватывающе тем, что может взрываться в процессе: нужно следить, чтобы не было частиц угля, чтобы не кипело слишком бурно и т.д. Хлорная кислота к тому же довольно грязная — её невозможно очистить субперегонкой, взрывается зараза! Поэтому используют её нечасто.
При попадании на кожу жжётся, ощущения как от соляной. Воняет. Когда видите в фильмах, что кто-то кинул труп в ёмкость с хлорной кислотой — и он растворился, то да, такое возможно — но долго или греть. Если греть — может рвануть (см. выше). Так что будьте критичны к кинематографу (я, кажется, видел это в «Кловерфилд, 10»).
Кстати, едкость оксида хлора (VII) Cl2O7 и оксида хлора (VI) Cl2O6 — это итог того, что с водой эти оксиды образуют хлорную кислоту.
А теперь представим, что мы решили в одном соединении объединить сильную кислотность — и едкость фтора: возьмём молекулу хлорной или серной кислоты — и заменим на ней все гидроксильные группы на фтор! Дрянь получится редкостная: она будет взаимодействовать с водой и подобными соединениями — и будет в месте реакции сразу получаться сильная кислота и плавиковая кислота. А?
Фториды серы, брома и иода
Помните, мы договорились рассматривать только жидкости? По этой причине в нашу статью не попал трифторид хлора ClF3
, который кипит при +12 °C, хотя все страшилки о том, что он жутко токсичен, воспламеняет стекло, противогаз и при разливании 900 килограммов — проедает 30 см бетона и метр гравия — всё это правда. Но мы же договорились — жидкости.
Однако есть жёлтая жидкость — пентафторид иода IF5
, бесцветная жидкость —
трифторид брома BrF3
, светло-жёлтая —
пентафторид брома BrF5
, которые не хуже. BrF5, к примеру, тоже растворяет стекло, металлы и бетон.
Аналогично — среди всех фторидов серы жидким является только декафторид дисеры (иногда её называют ещё пятифтористой серой) — бесцветная жидкость с формулой S2F10
. Но это соединение при обычных температурах достаточно стабильно, не разлагается водой — а потому не особо и едко. Правда, в 4 раза токсичнее фосгена с аналогичным механизмом действия.
Кстати, говорят, что пентафторид иода был «специальным газом» для заполнения атмосферы в спасательном шаттле в последних кадрах фильма «Чужой» 1979 года. Ну не помню, честно. Напомнился! Блин, там настолько круто, что я не удержался — и посвятил этому отдельную статью.
Даже нашёл, присмотрелся и понял, что Рипли там жила в таких суровых условиях, что инопланетный зверь — просто няшка

Суперкислоты
Термин «суперкислота» введён Джеймсом Конантом в 1927 году для классификации более сильных кислот, чем обычные минеральные кислоты. В некоторых источниках хлорную кислоту относят к суперкислоте, хотя это не так — она обычная минеральная.
Ряд суперкислот — это минеральные, к которым подцепили галоген: галоген тянет на себя электроны, все атомы очень сильно гневаются, а достаётся всё как обычно водороду: тот отваливается в виде Н+ — бабах: вот и кислота стала сильнее.
Примеры — фторсерная и хлорсерная кислоты
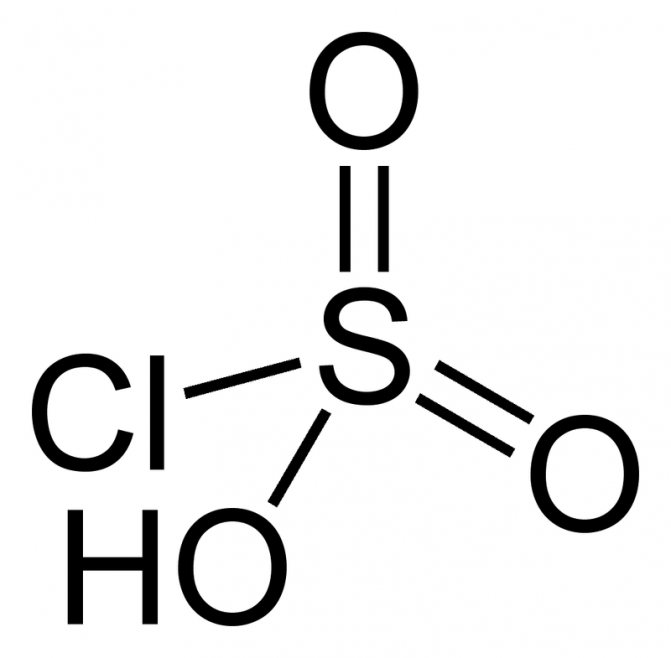
У фторсерной кислоты функция Гаммета -15,1, кстати, благодаря фтору, эта кислота постепенно растворяет пробирку, в которой хранится.
Потом кто-то из умных подумал: а давайте возьмём кислоту Льюиса (вещество, способное принять пару электронов другого вещества) и смешаем с кислотой Бренстеда (веществом, которое способно отдавать протон)! Смешали пентафторид сурьмы с плавиковой кислотой — получили гексафторсурьмяную кислоту HSbF6
. В этой системе плавиковая кислота выделяет протон (H+), а сопряжённое основание (F−) изолируется координационной связью с пентафторидом сурьмы. Так образуется большой октаэдрический анион (SbF6−), являющийся очень слабым нуклеофилом и очень слабым основанием. Став «свободным», протон обусловливает сверхкислотность системы — функция Гаммета -28!
А потом пришли другие и сказали, а чего это кислоту Бернстеда взяли слабую — и придумали вот что.
Трифторметансульфоновая кислота
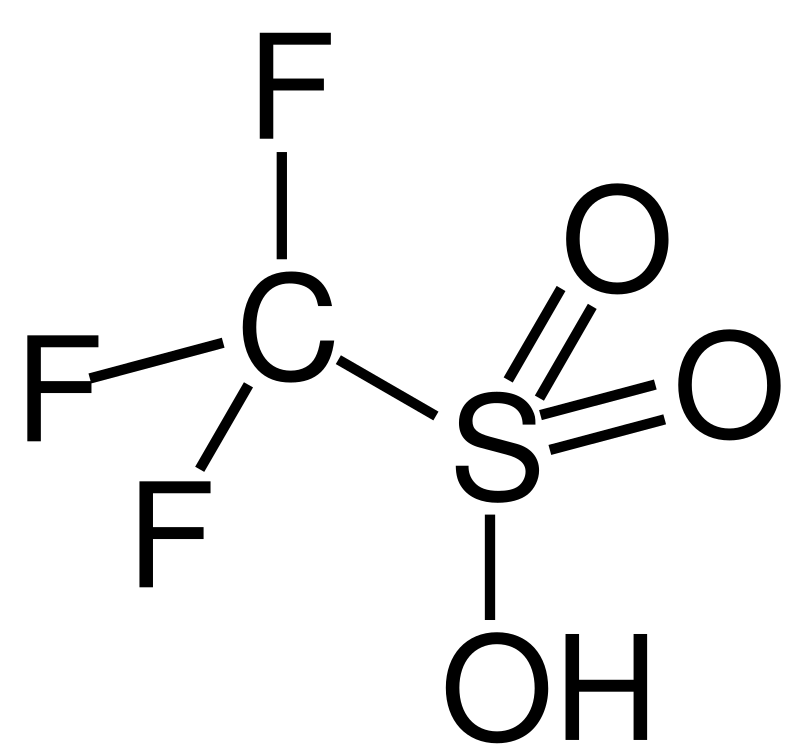
— сама по себе уже суперкислота (функция Гаммета -14,1). Так вот, к ней добавили опять пентафторид сурьмы — получили снижение до -16,8! Такой же фокус с фторсерной кислотой дал снижение до -23.
А потом группа ученых с химической кафедры американского университета Калифорнии под управлением профессора Кристофера Рида затусила с коллегами из Института катализа СО РАН (Новосибирск) и придумали карборановую кислоту H(CHB11Cl11). Ну «карборановой» её назвали для обычных людей, а если хочешь почувствовать себя учёным — произнеси «2,3,4,5,6,7,8,9,10,11,12-ундекахлор-1-карба-клозо-додекаборан(12)» три раза и быстро.
Так выглядит эта красотка
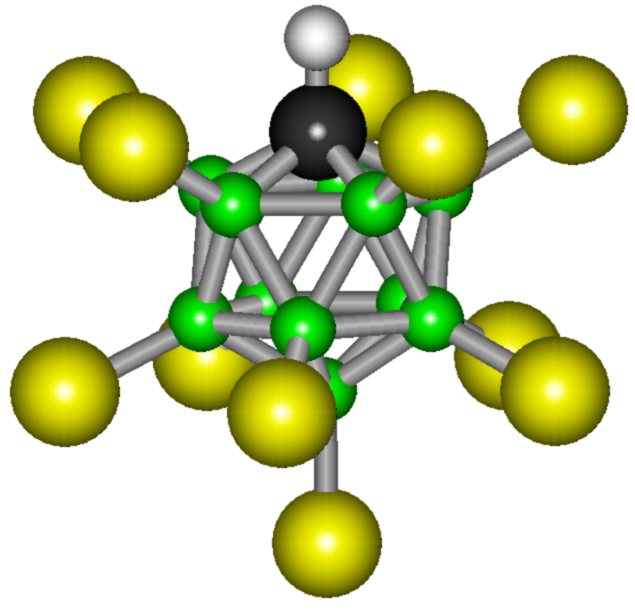
Это — сухой порошочек, который растворим в воде. Это и есть Самая Сильная Кислота на текущий момент. Карборановая кислота приблизительно в миллион раз сильнее концентрированной серной кислоты. В обычных шкалах измерить силу кислоты не удается, так как кислота протонирует все известные слабые основания и все растворители, в которых она растворяется, включая воду, бензол, фуллерен-60, диоксид серы.
Впоследствии Кристофер Рид в интервью службе новостей Nature сказал: «Идея синтеза карборановой кислоты родилась из фантазий «о молекулах, никогда прежде не создаваемых». Вместе с коллегами он хочет использовать карборановую кислоту для окисления атомов инертного газа ксенона — просто потому, что никто прежде этого не делал. Оригинально, что сказать.
Ну поскольку суперкислоты — это обычные кислоты, то и действуют они обычно, только немного сильнее. Ясно, что кожу будут жечь, но это не значит — что растворять. Фторсульфоновая — отдельный случай, но там всё благодаря фтору, как и в плавиковой.
Тригалогенуксусные кислоты
А конкретно — трифторуксусная и трихлоруксусная кислота
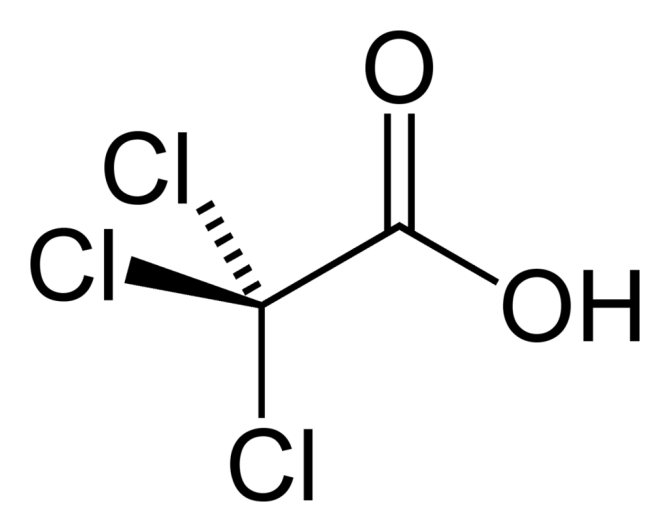
Милы и приятны сочетанием свойств органического полярного растворителя и достаточно сильной кислоты. Воняют — похоже на уксус.
Самая няшка — трифторуксусная кислота: 20%-ный раствор разрушает металлы, пробку, резину, бакелит, полиэтилен. На коже жжётся и образует сухие язвы, доходящие до мышечного слоя.
Трихлоруксусная в этом плане — младший брат, но тоже ничего. Кстати, аплодисменты слабому полу: в погоне за красотой, некоторые идут на так называемую процедуру ТСА-пилинга (ТСА — это TetraChloroAcetate) — когда этой самой трихлоруксусной кислотой растворяют верхний огрубевший слой кожи.
Правда, если косметолог заболтается по телефону, возможен фэйл
Уксусная кислота
СН3СООН
Скорее всего, у тебя на кухне есть эта кислота — и да, она используется как пищевая добавка Е260. Но также она бывает и покрепче — 70-80%-й водный раствор уксусной кислоты называют уксусной эссенцией, а если концентрация близка к 100% — ледяной уксусной кислотой (потому что она может замерзать и образовывать нечто похожее на лёд.
Уксусная кислота не так едка по отношению к металлам, как минеральные кислоты, но поскольку и не так полярна, а в какой-то степени даже дифильна (сочетание гидрофобной и гидрофильной части в одной молекуле — как в поверхностно-активных веществах) — то она здорово всасывается кожей. Опасными считаются растворы с концентрацией уксусной кислоты больше 30%. Особенность ожогов в том, что также инициируется развитие коагуляционных некрозов прилегающих тканей различной протяженности и глубины — если не смыть, то будут долго заживающие язвы и рубцы.
Ну и воняет она, конечно, знатно.
Муравьиная кислота
НСООН
Мы уже обсуждали, что муравьиная кислота, образующаяся в организме после принятия метанола, — одна из основных причин его токсичности. Так вот, муравьиная кислота извне вовсе не так опасна, поскольку быстро метаболизируется и выводится организмом. Токсичность довольно низка — для крыс LD50 порядка 1,8 г/кг, а потому муравьиную кислоту тоже часто используют, в том числе и как пищевую добавку — и этого бояться не стоит.
»Едкость» муравьиной кислоты зависит от концентрации. Согласно классификации Европейского союза, концентрация до 10% обладает раздражающим эффектом, больше 10% — разъедающим. И речь опять не о металлах и стекле — а об организме. При контакте с кожей 100%-я жидкая муравьиная кислота вызывает сильные химические ожоги. Попадание даже небольшого её количества на кожу причиняет сильную боль, поражённый участок сначала белеет, как бы покрываясь инеем, потом становится похожим на воск, вокруг него появляется красная кайма. Кислота легко проникает через жировой слой кожи, поэтому промывание поражённого участка раствором соды необходимо произвести немедленно. Так что муравьи действительно что-то знают.
Бром
Br2
Тяжёлая едкая жидкость красно-бурого цвета с сильным неприятным запахом, отдалённо напоминающим запах одновременно иода и хлора. Кстати, название «бром» от греческого βρῶμος — «вонючка», «вонючий».
Бром — типичный галоген, по химической активности бром занимает промежуточное положение между хлором и иодом. То есть не такой прыткий, как фтор — но поживее скучного иода. И да, до хлора тоже не дотягивает.
Немного растворим в воде, хорошо — в некоторых органических растворителях. Бромная вода — реактив на непредельные углеводороды — воняет, но вполне себе мирная и ничего сильно не растворяет.
Чистый бром могуч, вонюч и волосат, а также токсичен. При попадании на кожу вызывает ожоги: неприятность в том, что молекулы брома неполярны, а потому хорошо проникают в гидрофобную человеческую кожу и плоть — а потому ожоги действительно болезненны, долго заживают, почти всегда оставляют на память шрам. Алюминий вспыхивает при контакте с бромом, остальные металлы более воздержаны, но в виде порошка — некоторые реагируют, например, железо.
Бетон и стекло к брому достаточно устойчивы. Органические соединения бромом — что? — правильно! — бромируются при наличии ненасыщенной связи. По этой причине устойчивость полимеров зависит от их типа, к примеру полиэтилен и полипропилен — плевать хотели на бром при комнатных условиях.
Пероксид водорода
H2O2
Нестабильное соединение, которое постоянно постепенно разваливается на кислород и воду. Чем выше концентрация — тем нестабильнее, что постепенно превращается во взрывоопасность. Для стабилизации технического пероксида водорода в него добавляют пирофосфат или станнат натрия; при хранении в алюминиевых емкостях используют ингибитор коррозии — нитрат аммония.
Пероксид водорода в лаборатории обычно представляет собой раствор 38%. При попадании на кожу оказывает химический ожог с характерным белым окрашиванием. Ожог болезненный, особенно на тонкой коже, побелевшая ороговевшая кожа потом часто трескается и зудит.
В медицине используют 3% пероксид водорода для очистки глубоких ран сложного профиля, гнойных затёков, флегмон и других гнойных ран, санация которых затруднена — так вещество обладает не только антисептическим эффектом, но и создаёт большое количество пены при взаимодействии с ферментом каталазой. Это в свою очередь позволяет размягчить и отделить от тканей некротизированные участки, сгустки крови, гноя, которые будут легко смыты последующим введением в полость раны антисептического раствора. Кстати, перекись водорода нежелательна в других случаях ран: обладая хорошими очищающими свойствами, это вещество на самом деле не ускоряет процесс заживления, поскольку повреждает прилегающие к ране клетки, равно как и молодые, новообразующиеся ткани — а это ещё и чревато образованием рубцов.
Кроме как ожогов на коже — ничего не разъедает и не растворяет. Металлы, стекло и пластики устойчивы к пероксиду водорода.
А ещё пероксид водорода подарил миру много уникальных натуральных блондинок с чёрными корнями волос!
Близки к пероксиду водорода так называемые надкислоты — кислоты, в которых присутствуют пероксидные группы. Пример: надуксусная кислота СН3СОООН
— вещество, напоминающее по свойствам пероксид водорода, а потому и использующееся точно в таких же сферах. Есть «первомур» или «С-4» (нет, это не тот С-4, о котором ты подумал) — это
пермуравьиная кислота HCOOOН
, которая ещё слабее надуксусной, а потому хирируги моют ей руки перед операцией. И наконец —
трифторперуксусная кислота СF3СОООН
— лютый, бешеный окислитель, на который с восхищением смотрят химики-органики за возможность окисления анилина до нитробензола, получения гипервалентного иода в органических соединениях, реакцию Байера-Виллигера и другие малопонятные нормальным людям вещи. По едкости — трифторуксусная кислота, смешанная с перекисью водорода, чем, собственно, и является, а потому для рук представляет особую опасность, да. В виду своей высокой окислительной способности, трифторперуксусная кислота не продаётся, а обычно получается восхищающимися химиками-органиками прямо там, где необходимо, взаимодействием трифторуксусного ангидрида с пероксидом водорода.
Ну вот примерно так, если говорить про жидкость и про едкость. Будут ещё дополнения?











